Kim loại kiềm thổ và hợp chất của kim loại kiềm thổ đầy đủ nhất
Vị trí, cấu tạo, tính chất vật lý, tính chất hoá học và ứng dụng điều chế của kim loại kiềm thổ. các hợp chất quan trong của kim loại kiềm thổ: Canxi hiđroxit, Canxi cacbonat, Canxi sunfat, Nước cứng..
Ở bài trước, ta đã được tìm hiểu về Kim loại kiềm và các hợp chất của kim loại kiềm, và hôm nay, HocThatGioi sẽ cùng các bạn tiếp tục đi tìm hiểu về bài Kim loại kiềm thổ và các hợp chất của kim loại kiềm thổ. vậy kim loại kiềm thổ và kim loại kiềm có các tính chất khác nhau ở đâu? Tất tần tật về vị trí, cấu tạo, tính chất vật lý cũng như là tính chất hoá học, điều chế ứng dụng và các hợp chất quan trọng của kim loại kiềm thổ đã được HocThatGioi trình bày rất đầy đủ và chi tiết qua bài viết dưới đây nên các bạn cứ tham khảo thoài mái nhé!
1. Vị trí
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; trong một chu kì, kiềm thổ đứng sau kim loại kiềm.
- Kim loại kiềm thổ gồm: Beri (Be); Magie (Mg); Canxi (Ca); Stronti (Sr); Bari (Ba); Rađi (Ra) (Rađi là nguyên tố phóng xạ không bền).
2. Cấu tạo và tính chất của kim loại kiềm thổ
Bảng cấu hình electron, bán kính nguyên tử, năng lượng ion hoá I_2, độ âm điện, thế điện cực chuẩn và mạng tinh thể của các kim loại kiềm thổ.
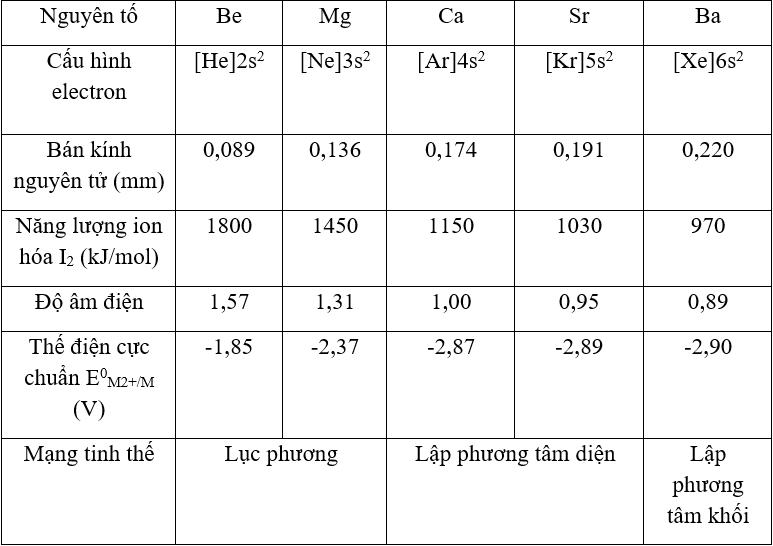
3. Tính chất vật lý
- Kim loại kiềm IIA gồm: Be: [He]2s2, Mg: [Ar]3s2, Ca: [Ar]4s2, Sr: [Kr]5s2, Ba: [Xe]6s2.
- Là những chất rắn màu trắng bạc hoặc xám nhạt, có ánh bạc, dẫn điện, dẫn nhiệt tốt.
- Nhiệt độ nóng chảy, nhiệt độ sôi tương đối thấp (cao hơn kim loại kiềm).
- Độ cứng: kim loại kiềm thổ cứng hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp; độ cứng giảm dần từ Be → Ba (Be cứng nhất có thể vạch được thủy tinh; Ba chỉ hơi cứng hơn chì).
- Khối lượng riêng tương đối nhỏ, độ cứng tuy cao hơn kim loại kiềm nhưng vẫn nhỏ hơn nhôm.
- Thế điện cực chuẩn:
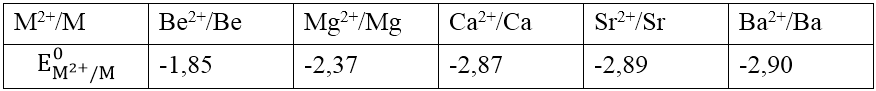
4. Tính chất hóa học
- Kim loại nhóm IIA là chất khử mạnh nhưng yếu hơn so với kim loại kiềm. Trong các hợp chất chúng có số oxi hóa +2.
- Tính khử tăng từ Be đến Ra: M – 2e → M^{2+}.
4.1 Tác dụng với phi kim
- Ở to thường, Be và Mg bị oxi hóa chậm tạo thành lớp màng oxit bảo vệ, các kim loại còn lại tác dụng với mạnh hơn.
- Khi đốt nóng tất cả các kim loại nhóm IIA đều cháy thành oxit: 2M + O_2 → 2MO.
Ví dụ:
- 2Ca + O_2 → 2CaO.
Với halogen:
Phản ứng dễ dàng ở nhiệt độ thường
- M + X_2 → MX_2.
Ví dụ:
- Mg + Cl_2 → MgCl_2.
Với phi kim kém hoạt động phải đun nóng:
- Ca+2C \overset{t^o}{\rightarrow} CaC_2 (Canxicacbua).
- Ca+ H_2 \overset{t^o}{\rightarrow} CaH_2 (Canxihiđrua).
- Mg + N_2 \overset{t^o}{\rightarrow}Mg_3N_2.
4.2 Tác dụng với nước
Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch bazơ.
- Ca + 2H_2O → Ca(OH)_2 + H_2↑.
Mg không tan trong nước lạnh, tan chậm trong nước nóng tạo thành MgO.
- Mg + H_2O → MgO + H_2↑.
Be không tan trong nước dù ở nhiệt độ cao vì có lớp oxit bền bảo vệ. Nhưng Be có thể tan trong dung dịch kiềm mạnh hoặc kiềm nóng chảy tạo berilat.
- Be + 2NaOH + 2H_2O → Na_2[Be(OH)_4] + H_2.
- Be + 2NaOH_{nchảy} → Na_2BeO_2 + H_2.
4.3 Tác dụng với axit
Axit không có tính oxi hóa, khử H^+ thành H_2
- M + 2H^+ → M^{2+} + H_2↑.
Ví dụ:
- Ca + 2HCl → CaCl_2 + H_2.
Khử N^{+5}, S^{+6} thành các hợp chất mức oxi hoá thấp hơn.
- 4M + 10HNO_3 (l) → 4M(NO_3)_2 + 3H_2O + NH_4NO_3.
Ví dụ:
- 4Ca + 10HNO_3 (l) → 4Ca(NO_3)-2 + NH_4NO_3 + 3H_2O.
- Mg + 4HNO_3 đđ → Mg(NO_3)_2 + 2NO_2 + 2H_2O.
5. Ứng dụng, điều chế
5.1 Ứng dụng
- Kim loại Be: làm chất phụ gia để chế tạo hợp kim có tính đàn hồi cao, bền, chắc, không bị ăn mòn.
- Kim loại Ca: dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép, làm khô 1 số hợp chất hữu cơ.
- Kim loại Mg có nhiều ứng dụng hơn cả: tạo hợp kim có tính cứng, nhẹ, bền để chế tạo máy bay, tên lửa, ôtô… Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh.
5.2 Điều chế
Điện phân nóng chảy muối halogenua
- MX_2 \overset{đpnc}{\rightarrow}M +X_2.
Ví dụ:
- CaCl_2 → Ca + Cl_2↑.
- MgCl_2 → Mg + Cl_2↑.
6. Các hợp chất quan trọng của kim loại kiềm thổ
6.1 Canxi hiđroxit (Ca(OH)2)
- Canxi hiđroxit (hay vôi tôi) là chất rắn, màu trắng, ít tan trong nước. Dung dịch Ca(OH)_2 gọi là nước vôi trong.
- Dung dịch Ca(OH)_2 có đầy đủ tính chất chung của một bazơ kiềm:
- Đổi màu chất chỉ thị: làm xanh quỳ tím, làm hồng phenolphtalein
- Tác dụng với axit, oxit axit, muối axit
- Tác dụng với dung dịch muối
Ứng dụng: Canxi hidroxit được ứng dụng trong các ngành công nghiệp phân bón (sản xuất amoniac), sản xuất clorua vôi, vật liệu xây dựng.

6.2 Canxi cacbonat (CaCO3)
- Canxi cacbonat là chất rắn màu trắng, không tan trong nước.
- Canxi cacbonat bị hòa tan trong axit
- Ở nhiệt độ cao (khoảng 1000oC), canxi cacbonat bị phân hủy
Trạng thái tự nhiên, ứng dụng
- Canxi cacbonat có trong đá vôi, đá hoa, đá phấn, là thành phần của vỏ sò, ốc,…
- Đá vôi được sử dụng làm vật liệu xây dựng, sản xuất vôi. Đá hoa được dùng để tạc tượng, trang trí… Đá phấn được dùng làm phụ gia kem đánh răng.

6.3 Canxi sunfat (CaSO4)
- Canxi sunfat là chất rắn, màu trắng, ít tan trong nước. CaSO_4 gọi là thạch cao khan.
- CaSO_4.2H_2O trong tự nhiên là thạch cao sống, bền ở nhiệt độ thường
- CaSO_4.H_2O là thạch cao nung. Thạch cao nung dùng để đúc tượng, làm bột bó trong y học, làm khuôn, làm phấn viết bảng.
6.4 Nước cứng
Nước cứng là nước chứa nhiều ion Ca^{2+}, Mg^{2+}. Nước mềm là nước chứa ít hoặc không chứa Ca^{2+}, Mg^{2+}
Người ta phân chia thành 3 loại
- Nước cứng tạm thời do các muối Ca(HCO_3)_2, Mg(HCO_3)_2.
- Nước cứng vĩnh cửu là do các muối CaCl_2, MgCl_2, CaSO_4, MgSO_4.
- Nước cứng toàn phần là nước có chứa tính cứng tạm thời và vĩnh cửu. (Nước tự nhiên có cả tính cứng tạm thời và vĩnh cửu).
Phương pháp làm mềm nước cứng:
- Dùng nhiệt độ
- Dùng OH^-
⇒ 2 phương pháp trên chỉ áp dụng với nước cứng tạm thời
- Dùng CO_3^{2-} hoặc PO_4^{3-}: áp dụng với mọi loại nước cứng
Phương pháp trao đổi ion: áp dụng với mọi loại nước cứng
Tác hại của nước cứng: Đóng cặn trong nồi hơi, ống dẫn nước; giảm mùi vị thức ăn; giảm hiệu quả của xà phòng,…

Cảm ơn các bạn đã theo dõi bài viết của HocThatGioi về Kim loại kiềm thổ và hợp chất của kim loại kiềm thổ đầy đủ nhất. Nếu các bạn thấy hay và bổ ích, hãy chia sẻ cho bạn bè của mình để cùng nhau học thật giỏi nhá. Đừng quên để lại 1 like, 1 cmt để tạo động lực cho HocThatGioi và giúp HocThatGioi ngày càng phát triển hơn nhé! Chúc các bạn học thật tốt!





