Lý thuyết về photpho và các hợp chất của photpho mới nhất
Xin chào các bạn, trong bài này HocThatGioi sẽ đưa ra chi tiết lý thuyết về photpho và các hợp chất của photpho. Đây là phần lý thuyết được HocThatGioi tóm tắt dễ hiểu nhất. Hãy đồng hành cùng chúng mình nhé!
1. Photpho
Đầu tiên ta đi tìm hiểu về các tính chất vật lí, tính chất hóa học và các ứng dụng của photpho trong đời sống.
1.1. Tính chất vật lí
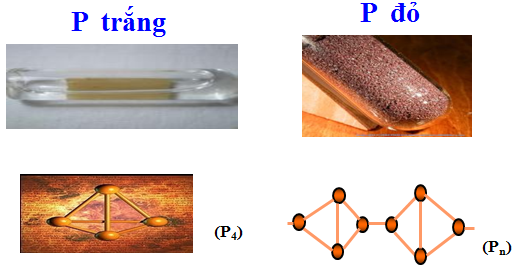
Có 2 loại photphot phổ biến đó là photpho trắng và photpho đỏ
– Photpho trắng: mạng tinh thể phân tử
- Rất độc, gây bỏng nặng khi rơi vào da.
- Ở nhiệt độ thường phát quang màu lục nhạt trong bóng tối.
- Bốc cháy trong không khí ở nhiệt độ > 40^{0}C.
\rightarrow Vì vậy ta cần bảo quản bằng cách ngâm trong nước
– Photpho đỏ: cấu trúc kiểu polime
- Là chất bột màu đỏ, dễ hút ẩm và chảy rữa.
- Cấu trúc polime \rightarrow khó nóng chảy và khó bay hơi hơn photpho trắng.
- Không tan trong các dung môi thông thường.
- Bền trong không khí ở nhiệt độ thường.
- Bốc cháy ở nhiệt độ > 250^{0}C
1.2. Tính chất hóa học
Photpho là một phi kim và hoạt động hóa học mạnh hơn nitơ
Các mức oxi hóa của P : -3, 0, +3, +5
Photpho trắng hoạt động mạnh hơn photpho đỏ
Nguyên tử khối của photpho là M = 31
1.2.1. Tính oxi hóa
p+kim\, \, loại\rightarrow photphua\,\, kim\, \, loạiVí dụ: 2P+3Ca\rightarrow Ca_3P_2(Canxi\, photphua)
1.2.2. Tính khử
– Phản ứng với phi kim: O_2, halogen,...
- 4P+3O_2\rightarrow 2P_2O_3 nếu O_2 thiếu.
- 4P+5O_2\rightarrow 2P_2O_5 nếu O_2 dư.
- 2P+3Cl_2\rightarrow 2PCl_3 nếu Cl_2 thiếu.
- 2P+5Cl_2\rightarrow 2PCl_5 nếu Cl_2 dư.
– Phản ứng với các chất oxi hóa khác
- 6P+5KClO_3\overset{t^0}{\rightarrow}3P_2O_5+5KCl
- P+5HNO_3\overset{t^0}{\rightarrow}H_3PO_4+5NO_2+H_2O
- 6P+K_2Cr_2O_7\overset{t^0}{\rightarrow}5K_2O+5Cr_2O_3+3P_2O_5
1.2.3. Trạng thái tự nhiên, ứng dụng và sản xuất
– Trạng thái tự nhiên
Không gặp photpho ở trạng thái tự do, chỉ gặp ở dạng muối photphoric
Ví dụ: 3Ca_3(PO_4)_2.CaF_2(apatit), Ca_3(PO_4)_2(photphoric)
– Ứng dụng
- Sản xuất axit photphoric
- Sản xuất diêm, bom, đạn,…
– Sản xuất
Ca_3(PO_4)_2+3SiO_2+5C\overset{1200^0C}{\rightarrow}3CaSiO_3+2P+5COTa thu được photpho trắng ở dạng rắn
2. Axit photphoric
Kí hiệu hóa học của axit photphoric là H_3PO_4
2.1. Tính chất vật lí
- Là chất rắn dạng tinh thể, trong suốt, không màu.
- Rất háo nước nên dễ cháy rữa.
- Axit photphoric thường dùng là dung dịch đặc, sánh.
2.2. Tính chất hóa học
2.2.1. Tính oxi-hóa khử
Photpho có mức oxi hóa +5 bền hơn nitơ
- \rightarrow axit H_3PO_4 khó bị khử
- \rightarrow không có tính oxi hóa như axit HNO_3
2.2.2. Tính axit
Axit H_3PO_4 là axit ba lần axit, có độ manh trung bình. Có đầy đủ các tính chất chung của axit.
Tác dụng với bazơ:
- H_3PO_4+NaOH\rightarrow NaH_2PO_4+H_2O
- NaH_2PO_4+NaOH\rightarrow Na_2HPO_4+H_2O
- Na_2HPO_4+NaOH\rightarrow Na_3PO_4+H_2O
2.3. Điều chế
– Trong phòng thí nghiệm:
P+5HNO_3(đặc)\overset{t^0}{\rightarrow}H_3PO_4+5NO_2+H_2O– Trong công nghiệp:
- Ca_3(PO_4)_2+3H_2SO_4(đặc)\overset{t^0}{\rightarrow}3CaSO_4+2H_3PO_4
H_3PO_4 không tinh khiết, có chất lượng thấp - 4P+5O_2 \overset{t^0}{\rightarrow} 2P_2O_5
P_2O_5+3H_2O\rightarrow 2H_3PO_4
H_3PO_4 có độ tinh khiết và nồng độ cao
3. Muối photphat
Muối photphat là muối của axit photphoric
Phân loại: gồm 3 muối
- Muối photphat trung hòa (PO_4^{3-})
- Muối đihidrophotphat (H_2PO_4^-)
- Muối hidrophotphat (HPO_4^{2-})
3.1. Tính chất của muối photphat
3.1.1. Tính tan
Tất cả các muối đihidrophotphat điều tan trong nước
Muối photphat trung hòa và muối hidrophotphat:
- Muối Na^+, K^+, NH_4^+ là dễ tan
- Còn lại đều không tan hoặc ít tan trong nước
3.1.2. Phản ững thủy phân
Na_3PO_4 +H_2O\rightleftharpoons Na_2HPO_4 + NaOHDung dịch Na_3PO_4 có môi trường kiềm
3.2. Nhận biết ion photphat
Để nhận biết ion photphat ta dùng thuốc thử là AgNO_3
3Ag+PO_4^{3-}\rightarrow Ag_3PO_4Ag_3PO_4 là chất kết tủa màu vàng
Trên đây là lý thuyết về photpho và các hợp chất của photpho. Cảm ơn các bạn đã theo dõi bài viết của HocThatGioi. Hi vọng rằng bài viết sẽ mang lại thêm các kiến thức về photpho cho bạn. Hãy đồng hành cùng HocThatGioi để tiếp thu thêm các kiến thức hay, bổ ích nhé. Chúc các bạn học tốt!