Lý thuyết về amin hay chi tiết nhất
Các định nghĩa về amin, bậc, công thức tổng quát và danh pháp của amin. Các tính chất vật lý và tính chất hoá học cũng như cách điều chế amin
Hôm nay, HocThatGioi sẽ cùng các bạn đi tìm hiểu tất tần tật về amin. Vậy amin là gì? Bậc của amin được tính thế nào? Danh pháp của amin được đọc ra sao? Tính chất vật lý cũng như tính chất hoá học của amin và cách để điều chế chúng. Các bạn hãy tham khảo bài viết dưới đây để có thể trả lời tất cả các câu hỏi trên một cách dễ dàng nhé!
1. Định nghĩa
1.1 Các định nghĩa về amin
- Amin là sản phẩm thu được khi thay thế nguyên tử H trong phân tử NH_3 bằng các gốc hiđrocacbon. (chỉ đúng với amin đơn chức).
- Amin là sản phẩm thu được khi thay thế nguyên tử H trong hidrocacbon bằng nhóm -NH_2 (chỉ đúng với amin bậc 1).
- Amin là hợp chất hữu cơ trong phân tử chỉ chứa 3 nguyên tố: C, H và N.
1.2 Bậc của amin
Bậc của amin là số gốc hiđrocacbon liên kết với nguyên tử N.
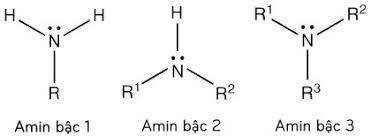
1.3 Công thức tổng quát của amin
Công thức tổng quát của amin có thể là một trong hai công thức dưới đây:
- C_xH_yN_z ( x, y, z thuộc N^*; y ≤ 2x + 2 + z; y chẵn nếu z chẵn; y lẻ nếu z lẻ).
- C_nH_{2n+2-2k+t}N_t (n thuộc N*; k thuộc N; t thuộc N*).
Lưu ý:
- Số liên kết pi + số vòng trong phân tử amin = (2x + 2 + t - y)/2.
- Nếu là amin bậc I thì công thức tổng quát có thể đặt là: C_nH_{2n+2-2k-t}(NH_2)_t..
2. Danh pháp
- Tên thay thế: Tên amin = Tên của hiđrocacbon tương ứng + Số thứ tự của C chứa nhóm NH2 + amin
- Tên gốc chức: Tên amin = Gốc hiđrocacbon + amin
- Tên thường: Anilin…
3. TÍNH CHẤT VẬT LÍ
- Các amin có khả năng tan tốt trong nước. Độ tan trong nước giảm khi số nguyên tử C tăng.
- Giữa amin và nước có liên kết Hiđro liên phân tử
- Metylamin, đimetylamin, trimetylamin và etylamin là chất khí, có mùi khai; các amin còn lại đều tồn tại ở trạng thái lỏng, rắn. Anilin: lỏng, không màu, độc ít tan trong nước dễ bị oxi hóa chuyển thành màu nâu đen.
4. TÍNH CHẤT HOÁ HỌC
4.1 Tính bazơ
Giải thích tính bazơ của các amin: Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
So sánh tính bazơ của các amin:
- Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH_3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
- Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH_3. Những amin này không làm xanh quỳ tím.
- Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
4.2 Các phản ứng thể hiện tính bazơ
4.2.1 Phản ứng với dung dịch axit
- CH_3NH_2 + H_2SO_4 → CH_3NH_3HSO_4.
- 2CH_3NH_2 + H_2SO_4 → (CH_3NH_3)_2SO_4.
- CH_3NH_2 + CH_3COOH → CH_3NH_3OOCCH_3.
4.2.2 Phản ứng với dung dịch muối tạo bazơ không tan
2CH_3NH_2 + MgCl_2 + 2H_2O → Mg(OH)_2 + 2CH_3NH_3Cl.
4.3 Phản ứng nhận biết bậc của amin
- Nếu là amin bậc I khi phản ứng với HNO_2 tạo khí thoát ra RNH_2 + HNO_2 → ROH + N_2 + H_2O.
- Anilin phản ứng tạo muối điazoni ở 0 → 5^oC: C_6H_5NH_2 + HNO_2 → C_6H_5N_2^+Cl^- + 2H_2O.
- Nếu là amin bậc II thì tạo hợp chất nitrozo màu vàng nổi trên mặt nước: RNHR’ + HNO_2 → RN(NO)R’ + H_2O.
- Amin bậc III không có phản ứng này.
4.4 Phản ứng nâng bậc amin
- RNH_2 + R’I → RNHR’ + HI.
- RNHR’ + R’’I → RNR’R’’ + HI.
4.5 Phản ứng riêng của anilin
- Anilin là amin thơm nên không làm đổi màu quỳ tím thành xanh.
- Anilin tạo kết tủa trắng với dung dịch nước Brom:

→ Phản ứng này được dùng để nhận biết anilin.
5. ĐIỀU CHẾ
5.1 Hiđro hóa hợp chất nitro
C_6H_5NO_2 + 2H_2 → C_6H_5NH_2 + 2H_2O (Fe/HCl).
5.2 Dùng kiềm mạnh đẩy amin ra khỏi muối amoni
C_6H_5NH_3Cl + NaOH → C_6H_5NH_2 + NaCl + H_2O.
→ Phản ứng này dùng để tách anilin ra khỏi hỗn hợp.
5.3 Thay thế nguyên tử H của NH3 (phản ứng nâng bậc)
NH_3 + RI → R - NH_2 + HICảm ơn các bạn đã theo dõi bài viết của HocThatGioi về Lý thuyết về amin hay chi tiết nhất. Nếu các bạn thấy hay và bổ ích, hãy chia sẻ cho bạn bè của mình để cùng nhau học thật giỏi nhá. Đừng quên để lại 1 like, 1 cmt để tạo động lực cho HocThatGioi và giúp HocThatGioi ngày càng phát triển hơn nhé! Chúc các bạn học thật tốt!





