Tính chất vật lí và tính chất hóa học của nhôm cực chi tiết
Trong bài này, HocThatGioi sẽ giúp các bạn hiểu rõ về tính chất vật lí và tính chất hóa học của nhôm. Đây là nguồn tài liệu rất hữu ích cho các bạn. Các bạn hãy đồng hành cùng HocThatGioi nhé!
1. Tính chất vật lí
Trước khi xét đến tính chất vật lí ta cần biết nhôm trong tự nhiên tồn tại và phổ biến như thế nào ?
Ở trong tự nhiên, nhôm là nguyên tố phổ biến thứ 3 (sau oxi và silic) và là kim loại phổ biến nhất trong vỏ Trái Đất. Nhôm chiếm khoảng 8% khối lượng rắn Trái Đất. Trong tự nhiên thì nhôm tồn tại chủ yếu dạng hợp chất ví dụ như: Đất sét (Al2O3.2SiO2.2H2O), Boxit (Al2O3.nH2O),. . .
Bây giờ ta cùng đi vào xem tính chất vật lí của nhôm có gì nhé !
- Nhôm là một kim loại nhẹ, màu trắng bạc, nóng chảy ở nhiệt độ 660oC
- Nhôm rất dẻo, có thể dát được lá nhôm mỏng 0,01 mm dùng để gói thực phẩm
- _{27}^{13}\textrm{Al} : 1s22s22p63s23p1 \rightarrow Nhôm nằm ở nhóm IIIA và chu kì 3
- Nhôm có cấu trúc tinh thể là lập phương tâm diện
2. Tính chất hóa học
Nhôm là một kim loại có tính khử mạnh: Al \rightarrow Al3+ + 3e
2.1 Tác dụng với dung dịch axit
Đối với dung dịch axit, Al có thể tác dụng với H^+(HCl,H_2SO_4 loãng) hoặc là các axit có tính oxi hóa mạnh (HNO_3 loãng hoặc đặc, H_2SO_4 đặc)
2.1.1 Tác dụng với H+ (HCl, H2SO4 loãng,…)
Al sẽ phản ứng dễ dàng để sinh ra muối và khí H2
Al + H+ \rightarrow muối + H2
Ví dụ: Al + HCl \rightarrow AlCl3 + H2
2.1.2 Tác dụng với các axit có tính oxi hóa mạnh (HNO3 loãng hoặc đặc, H2SO4 đặc)
Nhôm tác dụng với HNO3
Al +\: HNO_{3}\rightarrow Al(NO_{3}){3}+\left\{\begin{matrix} NO_{2} \\ NO \\ N_{2}O \\ N_{2} \\ NH_{4}NO_{3}\end{matrix}\right. + H_{2}OVí dụ:
Al + 6HNO3 đặc nóng \rightarrow Al(NO3)3 + 3NO2 + 3H2O
Nhôm tác dụng với H2SO4 đặc nóng
Al + 6H2SO4 \rightarrow Al2(SO4)3 + 3SO2 + 6H2O
2.2 Tác dụng với nước
Al không tác dụng với nước vì được lớp màng oxit mỏng bền bảo vệ. Nếu phá vở lớp màng oxit bảo vệ thì Al tác dụng được với nước.
2Al + 6H2O \rightarrow 2Al(OH)3 + 3H2O
2.3 Tác dụng với dung dịch kiềm
Khi cho Al vào dung dịch kiểm thì ta thấy Al tan hoàn toàn và tạo ra khí (H2).
Ví dụ:
- 2Al + 2NaOH + 2H2O \rightarrow 2NaAlO2 + 3H2
- 2Al + Ba(OH)2 + 2H2O \rightarrow Ba(AlO2)2 + 3H2
Thứ tự phản ứng
Khi cho Al vào dung dịch kiềm NaOH, KOH, Ba(OH)2,… thì Al sẽ tác dụng với nước sinh ra khí H2 và Al(OH)3. Do Al(OH)3 có tính lưỡng tính nên tiếp tục tan trong dung dịch kiềm tạo ra Al(OH)4–
Ví dụ: Khi cho Al vào dung dịch NaOH
- 2Al + 6H2O \rightarrow 2Al(OH)3 + 3H2
- Al(OH)3 + NaOH \rightarrow NaAlO2 + 2H2O
2.4 Tác dụng với phi kim
Tác dụng với Oxi
Al cháy trong không khí tạo ra ngon lửa màu sáng chói
4Al + 3O2 \rightarrow 2Al2O3

Tác dụng với các phi kim khác
- Al tự bốc cháy khi tiếp xúc với các halogen:
2Al + 3Cl2 \rightarrow 2AlCl3 - Al tác dụng với S:
2Al + 3S \rightarrow Al2S3
2.3 Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học tỏa nhiệt trong đó Al là chất khử ở nhiệt độ cao.
Ví dụ:
- 2Al + Fe2O3 \overset{t^{0}}{\rightarrow} 2Fe + Al2O3
- 2Al + 3CuO \overset{t^{0}}{\rightarrow} 3Cu + Al2O3
Nhiệt lượng do phản ứng nhiệt nhôm tỏa ra là rất lớn làm cho kim loại sinh ra bị nóng chảy. Vì lí do này nên người ta ứng dụng phản ứng này để điều chế sắt nóng chảy khi làm đường ray.
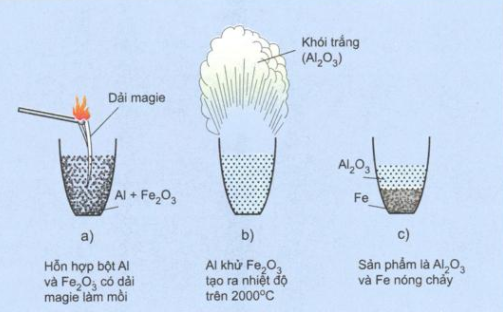
==> Xem thêm cách giải dạng bài phản ứng nhiệt nhôm và bài tập cực hay
Trên đây là các tính chất vật lí và tính chất hóa học của kim loại nhôm. Cảm ơn các bạn đã theo dõi bài viết của HocThatGioi. Hi vọng rằng bài viết sẽ mang lại thêm các kiến thức về kim loại nhôm cho bạn. Hãy đồng hành cùng HocThatGioi để tiếp thu thêm các kiến thức hay, bổ ích nhé. Chúc các bạn học tốt!





